Alkacymetria - Jak Zobojętnić Roztwór i Się Przy Tym Nie Zanudzić!
Alkacymetria - co to za potwór i jak go oswoić?
Alkacymetria brzmi groźnie, prawda? No cóż, może i brzmi jak coś, co mogłoby przestraszyć chemika na pierwszym roku, ale nie bój się! To po prostu sztuka miareczkowania kwasów i zasad – taka chemiczna wersja "mam cię!". Dzięki niej dowiesz się, ile kwasu lub zasady masz w próbce. To nic innego, jak trochę liczenia moli, a kto by nie lubił moli?
Jak to działa? Prosto jak drut... chemiczny!
Załóżmy, że masz w kolbie stożkowej kwas solny (HCl). W ręce trzymasz biuretę z wodorotlenkiem sodu (NaOH). Twoje zadanie? Połączyć te dwa składniki, żeby razem stworzyły... wodę z solą kuchenną! Tak, to serio chemia w kuchni. Oto reakcja:
HCl + NaOH → NaCl + H₂O
HCl+NaOH--> NaCl+H2O
Tadam! Magia zobojętniania w pełnej krasie.
Przed wkraplaniem do kolby stożkowej zasady, pH roztworu było bardzo niskie. Wraz z wkraplaniem zasady pH zaczęło się podnosić aż w końcu gdy cały HCl przereaguje z NaOH to układ się zobojętni. Właśnie ten moment chcielibyśmy określić jak najbardziej precyzyjnie, ponieważ znając dokładne stężenie wodorotlenku sodu jakie mieliśmy w biurecie, oraz wiedząc jaką ilość tego wodorotlenku wlaliśmy do kolby, możemy to przeliczyć na ilość moli, a następnie korzystając z reakcji powyżej bez problemu możemy to przeliczyć na ilość moli kwasu solnego.
Znając już ilość moli kwasu solnego w kolbie stożkowej oraz wiedząc jaką objętość mieliśmy, bez problemu możemy przeliczyć to na stężenie szukanego przez nas kwasu.
Skąd wiedzieć, że już czas skończyć? Wskaźniki na ratunek!
Kiedy miareczkujesz, nie robisz tego na ślepo – chyba że masz ochotę na chemię pełną niespodzianek. W tym celu używasz wskaźników, które jak magiczne farby zmieniają kolor w odpowiednim momencie. Najbardziej znany to fenoloftaleina – zmienia kolor na różowy, gdy pH roztworu wynosi około 8,3-10,0. Idealnie nadaje się, gdy miareczkujesz słaby kwas mocną zasadą. Fenoloftaleina to taka "chemiczna Barbie" – robi się różowa, kiedy jest zadowolona!
Taki układ ulega dalej hydrolizie, w wyniku czego pH takiego roztworu będzie nieco większe od 7. Właśnie dlatego, fenoloftaleina w takich układach świetnie się sprawdzi. Bardzo dobrze wyznaczy punkt, w którym jony ze sobą przereagują.
Równie znanym i często stosowanym jest oranż metylowy. On zmienia zabarwienie przy pH 3,1 - 4,4.To oznacza, że on się nadaje do miareczkowania słabej zasady, która miareczkujemy mocnym kwasem. Na skutek hydrolizy pH takiego roztworu będzie bardziej kwasowe i właśnie dlatego oranż metylowy świetnie się tutaj nada.
Podsumowując, jest cała baza różnych wskaźników, które zmieniają gwałtownie zabarwienie zależności od pH. Jeśli układ, w którym znajduje się wskaźnik podczas miareczkowania zmieni zabarwienie to jest to dla nas jasny sygnał, że należy zakończyć miareczkowanie i odczytać ile titranta wkropiliśmy do układu. Znając jego stężenie oraz objętość bez problemu przeliczymy to na ilość moli, a dalej z reakcji przeliczymy to na ilość moli analizowanej próbki.
Miareczkujemy jak mistrzowie chemii - krok po kroku
- Wlej kwas do kolby stożkowej.
- Napełnij biuretę zasadą.
- Powoli dodawaj zasadę, obserwując jak kolor wskaźnika zaczyna się zmieniać. Powoli, bo kto by chciał przegapić ten magiczny moment?
- Gdy zobaczysz zmianę koloru – stop! To twój moment chwały.
Teraz, mając te dane, możesz obliczyć stężenie kwasu (albo zasady). Wystarczy trochę matematyki i voila! Masz wynik.
Chcesz więcej chemicznych wyzwań?
Jeśli podobała Ci się ta krótka podróż przez świat alkacymetrii, to mam dla Ciebie coś jeszcze lepszego!
Na mojej stronie znajdziesz pełny kurs chemii analitycznej, który wciągnie Cię w świat miareczkowań, obliczeń i reakcji chemicznych jak nigdy wcześniej. Czeka na Ciebie prawie 7 godzin nagrań, w których krok po kroku tłumaczę najważniejsze zagadnienia – od podstaw po zaawansowane triki.
Nie przegap tej okazji i dołącz do kursu! Rozwiązuj więcej zadań, zrozum teorię od podszewki i stań się chemicznym mistrzem.
Kliknij tutaj, by dowiedzieć się więcej i zapisać na kurs!
Przykład z życia chemika - bo praktyka czyni mistrza
Zad 1. Ustal jakie jest stężenie molowe roztworu kwasu solnego (HCl) jeśli do zmiareczkowania roztworu węglanu sodu, w którym rozpuściłeś 0,2165g tego związku zużyłeś 22cm3 HCl.
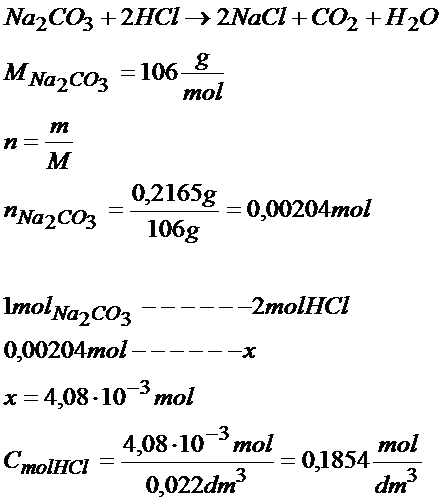
Odp: miareczkując kwas solny za pomocą węglanu sodu otrzymałem, że stężenie HCl jest równe 0,1854mol/dm3
Zad. 2 W wodzie została rozpuszczona pewna ilość węglanu sodu. Na zmiareczkowanie tego roztworu zużyto 20,3cm3 kwasu solnego o stężeniu 0,1835M. Ustal jaka masa węglanu sodu została rozpuszczona w układzie.
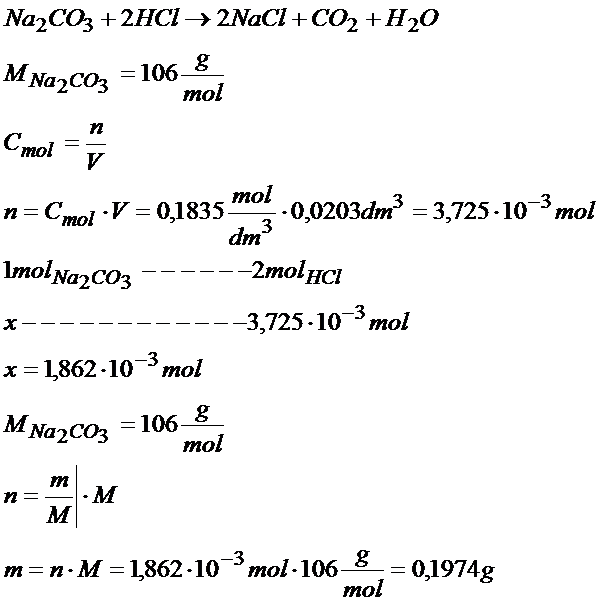
Odp. W roztworze zostało rozpuszczone 0,1974g węglanu sodu.
Zad. 3 Niewielka ilość sody kalcynowanej (m=1,1000g) rozpuszczono w wodzie w wyniku czego otrzymano jednorodny roztwór. Następnie taki układ miareczkowano kwasem siarkowym VI używając do tego celu 35cm3. Stężenie kwasu było równe 0,25M. Oblicz procentową zawartość sody w proszku wziętym do analizy.

Odp. Procentowa zawartość węglanu sodu w sodzie kalcynowanej jest równa 84,31%




