Stężenie molowe – jak to ogarnąć na wesoło?
Stężenie molowe to takie chemiczne „ile czegoś jest w czymś”. Ale spokojnie! Nie musisz być Sherlockiem, żeby to rozkminić. Pokażę Ci, jak to działa, a przy okazji może się nawet trochę uśmiechniesz!
Czym jest stężenie molowe? – Zanim zaczniesz, wyluzuj!
Wyobraź sobie, że masz wielki słoik lemoniady 1dm3 lub inaczej mówiąc 1L (to Twój roztwór). W środku są plasterki cytryny (to mole substancji). Stężenie molowe mówi Ci, ile takich plasterków cytryny (moli) jest w jednym słoiku (decymetrze sześciennym) lemoniady.
Prosty wzór, żeby nie było nudno!
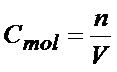
n – ilość moli
V- objętość dm3
Z tego wzoru wynika, że to stężenie można obliczyć dzieląc liczbę moli przez objętość roztworu.
Co to są mole i dlaczego nie mają futerka?
Dobra, mole to nie małe zwierzątka (i całe szczęście). W chemii mol to taka jednostka, która mówi, ile mamy cząsteczek czegoś. Stężenie molowe podaje ilość moli jaka się znajduje w 1 dm3 roztworu. Jeśli otrzymasz roztwór 2-molowy to znaczy, że masz 2 mole w jednym decymetrze sześciennym.
We wzorze powyżej, w liczniku, znajduje się „n” tzn. liczba moli. Ilość moli można obliczyć ze wzoru poniżej:
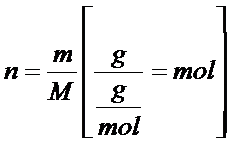
Z tego wzoru wynika, że ilość moli można obliczyć dzieląc masę próbki danego związku przez jego masę molową. Jak wzór na liczbę moli wstawimy do wzoru na stężenie to otrzymamy następujący wzór na stężenie molowe:
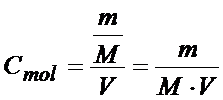
Więcej na ten temat znajdziecie w kursie „Podstawy chemii analitycznej”.
Przykłady na wesoło – bo najlepiej uczyć się na przykładach!
Zadanie 1 – ile cytryn w lemoniadzie?
W słoiku o objętości 1,5 dm³ znajduje się 6 moli (czyli 6 plasterków cytryny). Jakie jest stężenie molowe tego słoika? Okej, już liczymy:
Dane:
V=1,5dm3
n=6mol
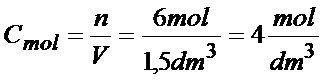
Odpowiedź: stężenie molowe roztworu jest równe 4mol/dm3 .
Zadanie 2 – ile plasterków w trzech słoikach?
Masz lemoniadę o stężeniu 2 mol/dm³. Ile moli (plasterków cytryny) znajdziesz w 3 dm³ lemoniady?
Dane:
Cmol=2mol/dm3
V=3dm3
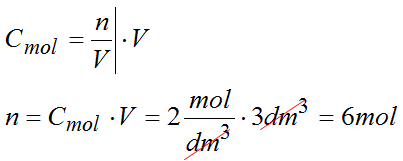
Odpowiedź: w roztworze znajduje się 6 moli tej substancji.
Zad. 3. Przeprowadź obliczenia, żeby ustalić w jakiej objętości znajdują się 2 mole substancji jeśli wiesz, że stężenie tego roztworu jest równe 0,5M.
Dane:
n=2mol
Cmol=0,5M
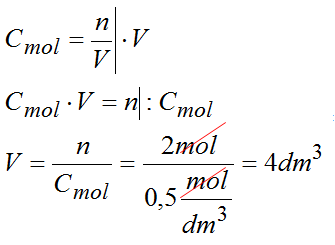
Odpowiedź: objętość roztworu to 4dm3
Zad. 4. W pewnej ilości wody rozpuściłeś 156g Na2S w wyniku czego otrzymałeś 3dm3 roztworu. Oblicz stężenie molowe siarczku sodu w roztworze.
Dane:
m=156g
V=3dm3
MNa2S=2*23g/mol+32g/mol=78g/mol
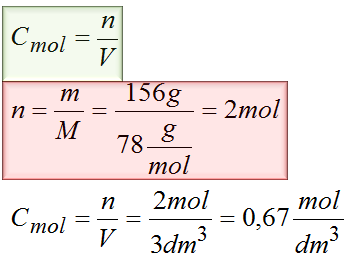
Odpowiedź: stężenie siarczku sodu jest równe 0,67mol/dm3
Zad. 5. Na pracowni chemicznej masz do dyspozycji roztwór wodorotlenku sodu o stężeniu 0,1M. W kolbie jednomiarowej znajduje się go 200cm3. Ustal ile gramów substancji zostało w nim rozpuszczone.
Dane:
Cmol=0,1M
V=200cm3=0,2dm3
MNaOH=23g/mol+16g/mol+1g/mol=40g/mol
m=?
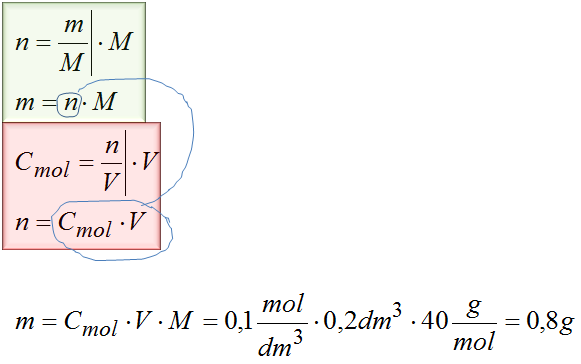
Odpowiedź: w roztworze zostało rozpuszczone 0,8g wodorotlenku sodu.
Podsumowanie – jak żyć z molami?
Stężenie molowe to nie jest czarna magia – to tylko trochę matematyki i cytryn! Ważne, żebyś pamiętał o prostych wzorach i proporcjach. A jeśli nie zrozumiesz za pierwszym razem, zawsze można nalać sobie kolejną lemoniadę i spróbować ponownie!
Zapraszamy na kursy online z chemii!
Chcesz w prosty i przyjemny sposób nauczyć się chemii? Mamy coś dla Ciebie! Zapraszam na moje dwa kursy dostępne online, które pomogą Ci opanować kluczowe zagadnienia i poczuć się pewnie w świecie molekuł i reakcji chemicznych.
-
Kurs Chemia – pełne kompendium wiedzy
Ten kurs to solidna dawka wiedzy, pełna wyjaśnień i przykładów, które sprawią, że chemia przestanie być zagadką. Idealny dla każdego, kto chce zrozumieć podstawy i rozwijać swoje umiejętności! -
Podstawy Chemii Analitycznej
Jeśli interesują Cię dokładne analizy i chcesz dowiedzieć się, jak sprawnie wykonywać obliczenia chemiczne, ten kurs jest dla Ciebie! Nauczysz się wszystkiego, od podstaw po bardziej zaawansowane techniki.
Zarejestruj się już dziś i odkryj, że chemia może być nie tylko łatwa, ale i przyjemna!



