Równania Hendersona-Hasselbalcha
Poniżej pokażę wyprowadzenie tego wzoru do buforu octanowego i amonowego. To równanie można wykorzystać do obliczenia pH buforu. Prawda jednak jest taka, że nie zawsze można takie równanie wykorzystać, ale szczegóły omówię już podczas wyprowadzenia wzoru.
I. Bufor octanowy
Bufor octanowy składa się z kwasu octowego i octanu sodu.
Zaczynamy najpierw od napisania reakcji dysocjacji kwasu i soli. Bufor octanowy jest buforem kwasowym. Jego pH jest niższe od 7. W takim roztworze zachodzą 2 reakcje dysocjacji. Kwas octowy dysocjuje w niewielkim stopniu, dlatego w reakcjach poniżej, przy kwasie, zastosowałem strzałkę z dwoma grotami. Ma to mówić o tym, że w tej reakcji zachodzi równowaga między tym co zdysocjowało a co nie zdysocjowało. Sól dysocjuje w 100%, dlatego grot strzałki jest skierowany tylko w stronę produktów.
CH3COOH < – > CH3COO- + H+
CH3COONa – > CH3COO- + Na+
W zestawie tych reakcji mamy reakcję kwasu, w której wytwarza się równowaga między tym co zdysocjowało, a tym co nie zdysocjowało, dlatego możemy do tego napisać stałą dysocjacji:
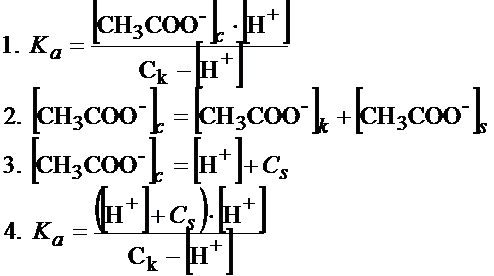
W liczniku pierwszego równania mamy stężenie jonów octanowych. W buforze, na stężenie tych jonów, wpływają jony octanowe pochodzące z dysocjacji kwasu oraz soli (równanie 2). Jeśli chodzi o jony octanowe pochodzące od kwasu to ich stężenie jest dokładnie takie same jak jonów wodorowych. Natomiast stężenie jonów octanowych soli jest dokładnie takie same jak stężenie soli (równanie 3). Następnie równanie 3 wstawiamy do równania 1, w wyniku czego otrzymujemy równanie 4.
Ze względu na to, że kwas octowy dysocjuje w bardzo niewielkim stopniu, mało tego, jeszcze sól cofa dysocjację kwasu octowego, w związku z czym możemy założyć, że stężenia części zdysocjowanej kwasu są bardzo, bardzo niewielkie. Są tak niewielkie, że możemy uznać je za znikomo małe i dokonać założeń.
Cs>>[H+]
Ck>>[H+]
Skoro stężenia jonów H+ są znikomo małe to możemy je usunąć z równania 4.
Oczywiście nie zawsze prawdą jest, że stężenia soli albo kwasu są dużo większe od stężenia jonów wodorowych. Przyjęło się, że jeśli te stosunki są mniejsze od 1% to założenia są słuszne i wówczas spokojnie można korzystać ze skróconych wzorów.
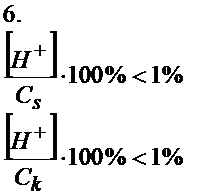
Jeśli te założenia sprawdzą się to wówczas można z równania 5 wyciągnąć na lewą stronę stężenie jonów wodorowych...
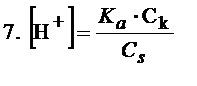
Po czym zlogarytmować obustronnie. Finalnie otrzymujemy wzór, z którego możemy obliczyć pH, a ten wzór to równanie Hendersona-Hasselbalcha.
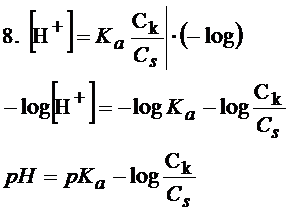
Ważna sprawa! Pamiętaj, że jeśli założenia z punktu 6 nie sprawdzą się to nie możesz uprościć równania i nie ma możliwości skorzystania z równania Hendersona-Hasselbalcha.
II. Bufor amonowy
Bufor amonowy należy do buforów o pH większym od 7. To wszystko za sprawą wody amoniakalnej.
Tak jak w buforze octanowym zaczynamy najpierw od reakcji dysocjacji
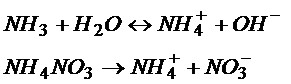
Amoniak jest słabą zasadą, więc w tej reakcji ustala się równowaga między tym co zdysocjowało a tym co nie zdysocjowało. A jeśli tak to przecież można napisać równania dysocjacji. Poniżej od razu zrobiłem założenia.
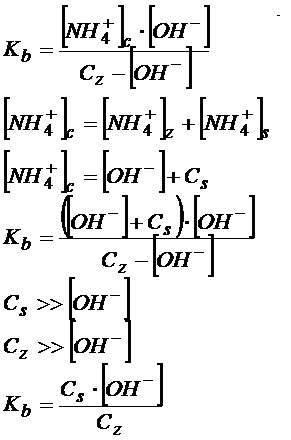
W tym miejscu jeśli chcemy wyprowadzić równanie Hendersona-Hasselbalcha to zakładamy, że założenia się sprawdzają i można skrócić wzór. Wyciągamy jony wodorotlenkowe na lewo
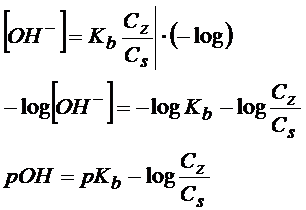
To co otrzymaliśmy to jeszcze nie jest równanie Hendersona-Hasselbalcha, bo nie jest to jeszcze wzór na pH. Żeby otrzymać wzór na pH to musimy skorzystać z iloczynu jonowego wody (równanie poniżej)
pKw=pH+pOH
pH= pKw- pOH
Z iloczynu jonowego wody otrzymałem równanie na pH. Teraz wystarczy tylko w miejsce pOH wstawić to co już wcześniej wyprowadziliśmy.
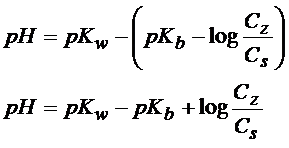
Dzięki temu podstawieniu otrzymaliśmy równanie Hendersona-Hasselbalcha dla buforu amonowego.
Jeśli chodzi o pKw to jest to wielkość zależna od siły jonowej. Nie mniej jednak jest to wartość równa mniej więcej 14. Moja rada: jeśli z treści zadania nie znasz dokładnej wartości pKw to najlepiej założyć, że jest to równe 14.
Poniżej znajduje się link do kursu, w którym dowiesz się więcej o równaniu Hendersona-Hasselbalcha.
W kursie rozwiązaliśmy sporo zadań z jego wykorzystaniem.




