Stała ciśnieniowa Kp, stała stężeniowa Kc i stała „ułamkowa” Kx
Generalnie o co chodzi w stałej równowagi reakcji? Chodzi o to, że niektóre reakcje znajdują się w równowadze, to znaczy, że stężenie substratów i produktów cały czas jest na tym samym poziomie. Patrząc z boku na układ wydawałoby się, że taka reakcja zatrzymała się, bo i produktów i substratów cały czas mamy tyle samo. Gdyby jednak zerknąć głębiej to byłoby widać, że nie ma tam wcale takiej stagnacji jakby się nam wydawało na pierwszy rzut oka. W takim układzie cały czas powstają produkty i substraty, z tym że szybkość powstawania produktów i substratów cały czas jest taka sama (są sobie równe)! Z tego powodu w układzie stężenie produktów i substratów cały czas jest takie same. Nazwałbym ten proces, tak przewrotnie „dynamiczną stagnacją”, bo niby w układzie nic się nie dzieje (stężenia cały czas są takie same), natomiast reakcja nieustannie zachodzi.
Poniżej wyprowadzenie stałej stężeniowej Kc na podstawie poniższej reakcji.
2NO+O2 = 2NO2
Jeśli układ znajduje się w równowadze to, tak jak już napisałem wcześniej, szybkość powstawania produktów i substratów musi być taka sama.
Poniżej wzory na szybkość tych reakcji ( więcej na ten temat dowiesz się w kinetyce chemicznej. Uwaga nie mylić z KINEMATYKĄ).
Szybkość powstawania substratów: V=k1*C2NO*CO2
Szybkość powstawania produktów: V=k2*C2NO2
Skoro obie te szybkości są sobie równe to znaczy, że jedną szybkość możemy przyrównać do drugiej, a wtedy otrzymamy:
k1*C2NO*CO2= k2*C2NO2
W kolejnym kroku trzeba wszystkie stałe przerzucić na lewą stronę równania, a stężenia na prawą, w wyniku czego otrzymujemy:
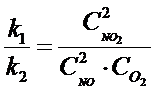
Taki stosunek stałej równowagi reakcji powstawania substratów ( k1) do produktów (k2) zastąpmy jedną stałą, która będzie odnosiła się do całej reakcji (a nie osobno do substratów i produktów). Z racji tego, że są w niej stężenia to nazwijmy ją stałą stężeniową Kc:
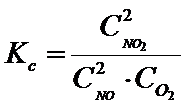
Teraz uwaga!! Praktycznie we wszystkich artykułach w Internecie w tym miejscu popełnia się błąd, a mianowicie stałą ciśnieniową zostawia się w takiej formie jak wyżej. W zasadzie w mojej ocenie to jest błąd. Dlaczego? A dlatego, że przyjęło się, że wszelkie stałe wykorzystywane w chemii są bezwymiarowe (czyli nie mogą mieć żadnej jednostki), a w tym przypadku tak nie jest! Sam zobacz. Stężenia podajemy w mol/dm3. Wstawmy tę jednostkę w miejsca stężeń we wzorze powyżej.
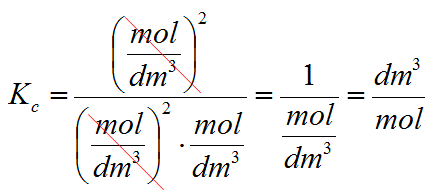
Jak widzisz jednostki się nie poskracały! Z tego powodu dla formalności w stałej ciśnieniowej każde stężenie należy podzielić przez stężenie standardowe, którego wartość jest równa Co=1mol/dm3.
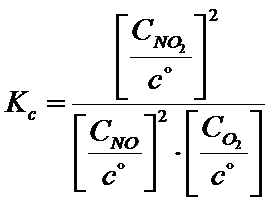
Dzielenie przez 1 nic nie zmienia, z matematycznego punktu widzenia, ale dzięki temu jednostki się skracają.
W przypadku stałej stężeniowej dzielenie przez stężenie standardowe to tylko formalność i jeśli będziesz pamiętał, że wynik musi być bez jednostki to można sobie to darować. Wówczas wzór na stałą stężeniową rzeczywiście można zapisać w następujący sposób:
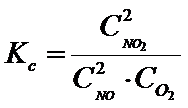
W przypadku stałej stężeniowej można tak zrobić, ale w przypadku stałej ciśnieniowej Kp nie bardzo.
Gdy masz do czynienia z gazami to w miejsca stężeń można wstawić ciśnienia parcjalne (cząstkowe) każdego z reagentów ( tak można robić tylko w przypadku gazów, zapamiętaj!)
2NO+O2 = 2NO2
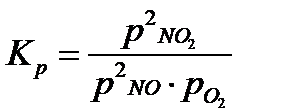
I z takim wzorem na stałą ciśnieniową spotkasz się w zasadzie w każdym artykule na Internecie. Mamy tutaj dokładnie ten sam problem z jednostkami co poprzednio. Zapamiętaj, że wszystkie stałe tzn. Kp, Kc i Kx muszą być bez jednostki. W tym przypadku tak nie jest! Jeśli ciśnienie będziesz podawał w paskalach to będziesz miał następującą sytuację:
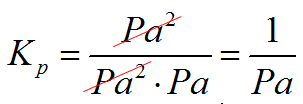
W takim przypadku koniecznie trzeba pamiętać aby każde z ciśnień parcjalnych podzielić przez ciśnienie standardowe, które jest równe po=1atm=101325Pa
A więc stała ciśnieniowa poprawnie wygląda w następujący sposób:
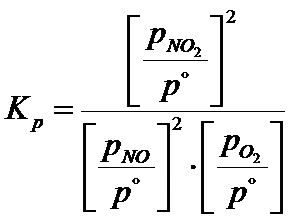
Gdy ciśnienie podajesz w atmosferach to nie ma problemu, podobnie jak w przypadku stałej stężeniowej można je ominąć, bo ciśnienie standardowe jest równe 1 atm. Dzielenie przez 1 nic nie zmienia. Musisz tylko pamiętać, żeby nie podawać jednostki. Gorzej jeśli ciśnienia podajesz w paskalach. Wówczas jeśli każdego z nich nie podzielisz przez 101325Pa to popełnisz bardzo, bardzo duży błąd. O tym musisz pamiętać!
Jest jeszcze coś takiego jak stała wynikająca z ułamków molowych Kx. Ja ją nazwałem stałą ułamkową. W stałej ułamkowej nie trzeba się przejmować jednostkami, dlatego że ułamki molowe z zasady nie mają jednostki. Wzór na stałą ułamkową wygląda w następujący sposób:
2NO+O2 = 2NO2
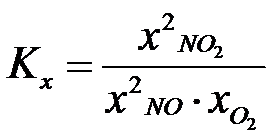
Co to jest ułamek molowy? Jest to liczba moli danego reagenta podzielona przez całkowitą liczbę moli wszystkich reagentów znajdujących się w układzie.
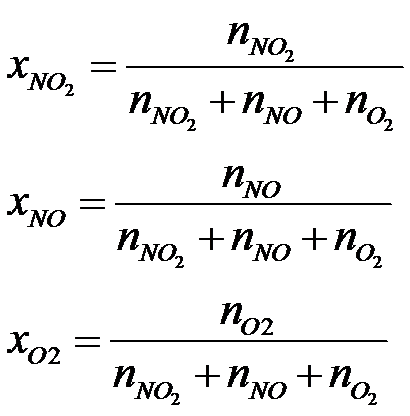
Istnieje zależność między stałą Kp, Kc a Kx. Stałą ciśnieniową można wyprowadzić np. ze stałej stężeniowej, a stałą ułamkową ze stałej ciśnieniowej. Te zależności omówiłem w kolejnym artykule. Link do niego znajdziesz tutaj: https://fizyka-kursy.pl/blog/zwiazek-pomiedzy-stala-rownowagi-kp-kx-oraz-kc
Stałych w chemii jest znacznie więcej, np. stała hydrolizy czy chociażby stała dysocjacji. To wszystko omówiłem w kursie Hydroliza: https://fizyka-kursy.pl/kurs/hydroliza
Jeśli natomiast chciałbyś zgłębić wiedzę na temat stałych Kp, Kc i Kx i policzeniu zadań z tego tematu to zachęcam do skorzystania z mojego kursu z Powinowactwa chemicznego i entalpii swobodnej. https://fizyka-kursy.pl/kurs/potencjal-chemiczny-entalpia-swobodna





