Związek pomiędzy stałą równowagi Kp, Kx oraz Kc
Jeśli chodzi o stałą stężeniową to we wcześniejszym artykule wytłumaczyłem jak należy to wyprowadzić i z czego to wynika. Link tutaj: https://fizyka-kursy.pl/blog/stala-cisnieniowa-kp-stala-stezeniowa-kc-i-stala-ulamkowa-kx
A poniżej, w wielkim skrócie, przypomnienie jak to należało zrobić:
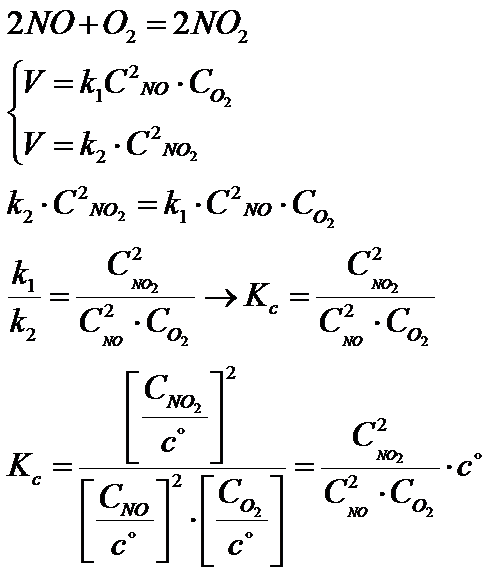
W tym artykule nie będę skupiał się na wytłumaczeniu co to jest Kp, Kx i Kc ponieważ zrobiłem to już w poprzednim. W tym artykule bardzo mi zależy na tym aby wyprowadzić zależność między Kp, Kx i Kc.
Na pierwszy ogień idzie przejście ze stałej ciśnieniowej Kp na stałą stężeniową Kc
Najpierw trzeba napisać wzór na stałą Kp dla jakiejś konkretnej reakcji:
2NO+O2 = 2NO2
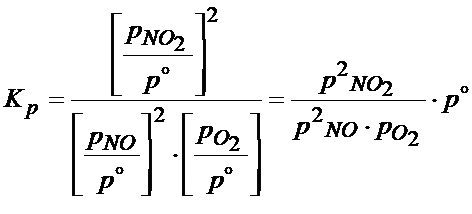
W przypadku gazów doskonałych do ich opisu można wykorzystać równanie Clapeyrona. Równanie Clapeyrona można tam przekształcić żeby znalazło się w nim stężenie. Poniżej zobacz jak to można zrobić:
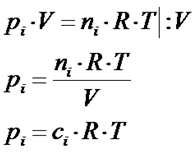
Więcej na temat równania Clapeyrona i kiedy można je wykorzystywać do opisu rzeczywistości opisałem w artykule z linku https://fizyka-kursy.pl/blog/rownanie-sztywnych-kul
W kolejnym kroku można ciśnienia parcjalne zastąpić tym wyrażeniem, które wynika z równania Clapeyrona w wyniku czego otrzymujemy to co poniżej:
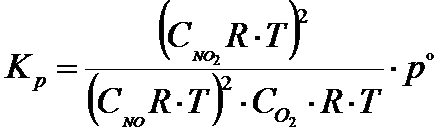
Pamiętaj, że po to ciśnienie standardowe równe po=1atm=101325Pa
Po dalszych przekształceniach otrzymujemy ostateczny wzór dla reakcji powyżej, który łączy ze sobą stałą ciśnieniową i stałą stężeniową:
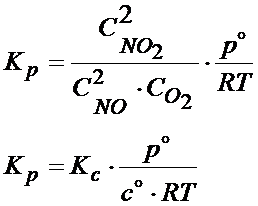
Ten wzór jednak nie jest wzorem ogólnym, który posłowałby do wszelkiego rodzaju reakcji chemicznych. Jest to tylko wzór pasujący do reakcji jak powyżej a ten wywód ma na celu pokazać Ci jak można w praktyce wyprowadzać takie zależności. Jeśli natomiast chodzi o wzór ogólny to spójrz poniżej:

Teraz wyprowadzimy zależność między stałą ciśnieniową a stałą wynikającą z ułamków molowych tzw. stałą ułamkową dla następującej reakcji: 2NO+O2 = 2NO2
Oczywiście najpierw trzeba wyjść od stałej ciśnieniowej
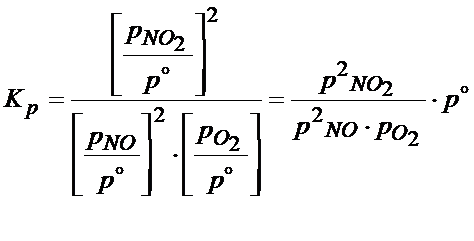
Następnie należy skorzystać z prawa Daltona z którego wynika, że ciśnienie parcjalne jest równe ciśnieniu całkowitemu razy ułamek molowy:
pi=pc*xi
Po wprowadzeniu tej zależności do wzoru na stałą ciśnieniową otrzymujemy:
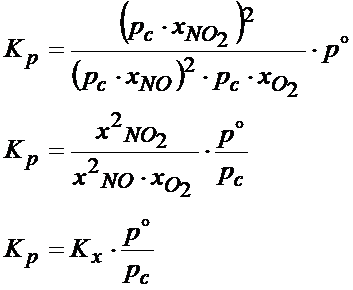
W taki oto sposób można połączyć ze sobą Kp i Kx. Jeśli natomiast chodzi o wzór ogólny, który pasowałby do każdego typu reakcji przedstawiam Ci go poniżej:
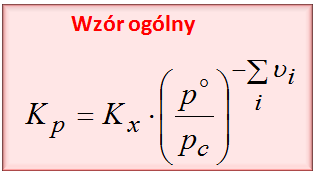
Zapraszam do mojego kursu, w którym poćwiczysz to w praktyce https://fizyka-kursy.pl/kurs/potencjal-chemiczny-entalpia-swobodna 



