Reguła faz Gibbsa – czym są stopnie swobody i jak je zrozumieć?
Witajcie w świecie termodynamiki! Dziś na tapecie – reguła faz Gibbsa i stopnie swobody. Wiem, brzmi to jak matematyczna zagadka, ale obiecuję, że nie będzie boleć! Czym są te tajemnicze stopnie swobody? Przede wszystkim chodzi o to, że możemy coś zmieniać w jednym kierunku bez ograniczeń, a w innym już nie. Brzmi prosto, prawda? A teraz zamieńmy teorię na coś, co da się przyswoić bez popijania kawy litrami!
Stopnie swobody – co to jest? Czyli lekcja z mechaniki
Na pewno gdzieś już słyszałeś o stopniach swobody, może na fizyce, może przy piwie z kolegą-naukowcem (jeśli masz takich znajomych, to gratuluję cierpliwości!). W mechanice stopnie swobody to ile razy i w jakich kierunkach ciało może się poruszać.
Ciało punktowe – 3 kierunki, 3 stopnie swobody
Wyobraź sobie, że masz magiczny punkt, który można przesuwać we wszystkich trzech kierunkach przestrzeni: w przód, w bok i w górę. Takie ciało punktowe ma trzy stopnie swobody. Co za swoboda, prawda?
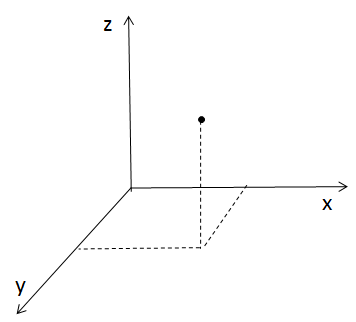
Ciało na lodzie – poślizg kontrolowany, czyli 2 stopnie swobody
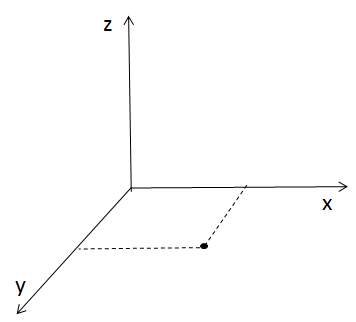
A teraz wyobraź sobie, że to samo ciało poślizgnie się po tafli lodu (nie polecam próbować na własnym ciele, bo to kończy się siniakami!). Na lodzie ciało może poruszać się tylko w dwóch kierunkach, więc ma tylko dwa stopnie swobody. Proste!
Stopnie swobody w termodynamice – nowa oś, nowa zabawa!
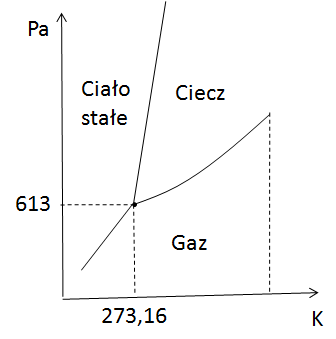
Skoro już opanowałeś mechanikę, czas na termodynamikę. Tutaj też mamy stopnie swobody, ale zamiast przesuwać ciało w przestrzeni, bawimy się ciśnieniem i temperaturą. Zamiast osi x, y, z, mamy wykres z temperaturą i ciśnieniem. Więc zapytajmy – ile mamy stopni swobody w danym punkcie na wykresie? I tutaj wchodzi reguła faz Gibbsa, cała na biało.
Zielony obszar – dwa stopnie swobody, czyli pełna kontrola
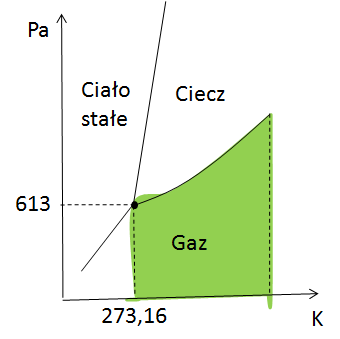
Zastanów się co mażesz swobodnie zmieniać aby przemieszczać się po zielonym obszarze? Oczywiście swobodnie możemy zmieniać temperaturę i ciśnienie. Tak więc ile mamy stopni swobody? Oczywiście w tym przypadku mamy 2 stopnie swobody.
Czerwona kropka – tylko jeden stopień swobody
Teraz wyobraź sobie, że znalazłeś się na linii przemiany fazowej (jak ta czerwona kropka). W takim przypadku możesz zmieniać tylko jedną wielkość – ciśnienie albo temperaturę. Druga zmienia się automatycznie, więc jest skorelowana. Trochę mniej swobody, ale ciągle możesz coś zmieniać.
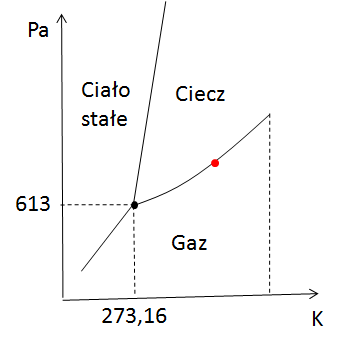
Jeśli chcesz przemieszczać się na linii przemiany fazowej to tak naprawdę możesz zmieniać jedną wielkość albo temperaturę, albo ciśnienie (jedną z nich możesz wybrać). Druga wielkość natomiast jest z tą pierwszą powiązana funkcją. Tak więc na linii przemiany fazowej mamy jeden stopień swobody. Jeśli jeszcze nie do końca to czujesz, to w takim przypadku najlepiej pokazać to na przykładzie. Załóżmy, że odcinek, na którym jest czerwona kropka można opisać za pomocą funkcji liniowej. Przykład takiej funkcji poniżej (jest to oczywiście przypadkowa funkcja, która ma tylko na celu pokazać Ci tę korelację).
p=142T+58
p- ciśnienie
T- temperatura
Punkt potrójny – zero stopni swobody, czyli absolutny bezruch
A teraz dochodzimy do punktu potrójnego, miejsca, gdzie stykają się wszystkie fazy: ciało stałe, ciecz i gaz. Wyobraź sobie, że próbujesz coś zmienić – zmieniasz temperaturę, ciśnienie... i bum! Jesteś poza punktem potrójnym. Tutaj nie ma żadnej swobody. Zero, null, żadnych ruchów.
Reguła faz Gibbsa – tajemniczy wzór, który wszystko tłumaczy
Jak już wiemy co to jest „stopień swobody” to w końcu możemy omówić równanie opisujące równowagę faz.
Wzór wygląda w następujący sposób:
S=a-b+2
Gdzie:
s- liczba stopni swobody
a- liczba składników (w układach jednoskładnikowych mamy tylko 1 składnik np. wodę)
b - liczba faz w danym punkcie (np. w punkcie potrójnym trzy fazy stykają się ze sobą)
Co jeśli zachodzi reakcja chemiczna? Dodajemy trochę „r”!
A co, jeśli w układzie zachodzi reakcja chemiczna? No to wzór lekko się komplikuje i dorzucamy człon „r”, który oznacza liczbę niezależnych reakcji:
S=a-b+2-r
r- liczba niezależnych reakcji chemicznych zachodzących w układzie.
Podsumowanie – Gibbsa mamy z głowy!
Teraz już wiesz, czym są stopnie swobody, jak działa reguła faz Gibbsa i dlaczego zmiana ciśnienia na linii przemiany fazowej to temat delikatny. Nie bój się wzorów, one naprawdę są mniej groźne niż wyglądają! Na koniec, jeśli chcesz zgłębić temat, zajrzyj do kursu "Równowagi fazowe w układach jednoskładnikowych" – bo kto nie chciałby mieć jeszcze więcej radości z nauki o fazach?
https://fizyka-kursy.pl/kurs/rownowagi-fazowe-w-ukladach-jednoskladnikowych




