Równowagi fazowe w układach jednoskładnikowych - zadania
Treść zadania: Entalpia parowania pewnej substancji pod ciśnieniem 10,13*105 Pa w temperaturze -29,9oC wynosi 20,25 kJ/mol. Oblicz jakie ciśnienie będzie w zbiorniku jeśli podwyższymy temperaturę do 40oC.

To zadanie opiera się na równaniu Clausiusa-Clapeyrona dlatego, że łączy w sobie zmianę temperatury, zmianę ciśnienia i entalpię przemiany fazowej, czyli wszystko to co jest w równaniu Clausiusa Clapeyrona.
Trzeba oczywiście zacząć od równania:
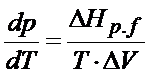
Kolejna kwestia, którą warto zrobić na tym etapie to rozpisać ΔV. Patrz na dalsze rozwiązanie poniżej:
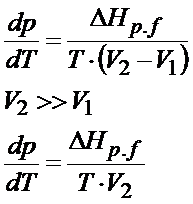
Delta to oczywiście różnica, tak więc od objętości V2 trzeba odjąć objętość V1. Mamy tutaj do czynienia z parowaniem, a parowanie to przejście z cieczy do gazu. Tą drugą objętością jest objętość gazu. Zapamiętaj, że objętość gazu jest dużo, dużo większa od objętości cieczy. A skoro tak to objętość cieczy, czyli V1 można pominąć w tym wzorze uznając ją za pomijalnie małą. Jednym słowem zostanie nam tylko objętość gazu. W tym zadaniu możemy założyć sobie, że gaz zachowuje się jak gaz doskonały więc do jego opisu można zastosować równanie Clapeyrona. Kiedy tak nie można założyć? A wtedy gdy w treści zadania jest wyraźnie napisane, że gaz zachowuje się jak gaz doskonały, a do jego opisu należy zastosować np. równanie van der Waalsa lub jakieś inne równanie.
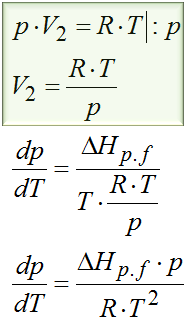
Po wstawieniu równania na objętość otrzymujemy postać jak powyżej. Otrzymaliśmy tutaj równanie różniczkowe tzn. równanie z pochodnymi. Żeby je rozwiązać to najpierw trzeba rozdzielić zmienne, tzn. wszystko co jest związane z ciśnieniem przerzucić na lewo, a to co z temperaturą na prawo.
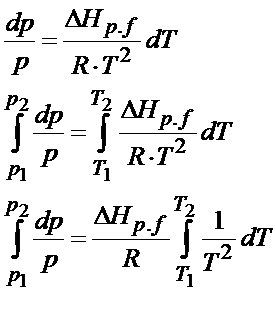
Dodatkowo trzeba wyrzucić przed znak całki wszystkie stałe. Zakładamy w tym zadaniu, że entalpia również jest wartością stałą. Ona oczywiście zależy od temperatury, a tę zależność przedstawia prawo Kirchhoffa. W większości przypadków jednak wpływ temperatury na entalpię się pomija, bo entalpia zazwyczaj nie zależy w mocny sposób od temperatury. Dlatego w niewielkim zakresie temperatur można to zupełnie pominąć. Nie zawsze jednak da się tak zrobić. Tego typu zadanie rozwiązałem w moim kursie Równowagi fazowe w układach jednoskładnikowych https://fizyka-kursy.pl/kurs/rownowagi-fazowe-w-ukladach-jednoskladnikowych
Pamiętasz jeszcze jak należy obliczyć całkę 1/T^2? Jeśli nie, to nic nie szkodzi. Nie będę Cię zmuszał do szukania po notatkach jak to należy zrobić. Poniżej bardzo szczegółowo rozpisałem tę całkę. Do tego trzeba jeszcze wprowadzić granice całkowania.
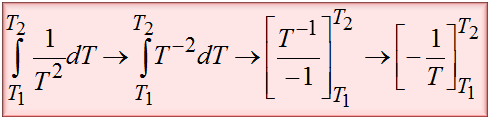
Teraz można już dokończyć obliczenia. Poniżej je znajdziesz.
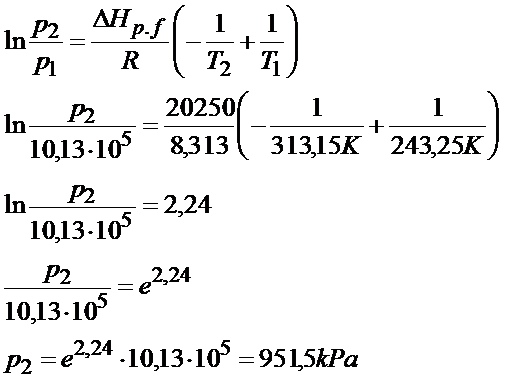
Po wprowadzeniu danych do równania i po maksymalnym uproszczeniu układu otrzymałem proste równanie logarytmiczne. Stosując własności logarytmów wyszło mi, że ciśnienie jest równe 951,2 kPa.
Więcej na ten temat dowiesz się w moim kursie Równowagi fazowe w układach 1-składnikowych
https://fizyka-kursy.pl/kurs/rownowagi-fazowe-w-ukladach-jednoskladnikowych



