Hydroliza - Supermoc Chemii, Którą Musisz Poznać!
Czy zdarzyło Ci się kiedyś zgubić w chemicznym labiryncie? Jeśli tak, to witaj w klubie! Dziś opowiemy o hydrolizie – procesie, który godzi wiecznie kłócących się chemików organicznych i nieorganicznych. Przygotuj się na dawkę wiedzy okraszoną odrobiną humoru, bo chemia wcale nie musi być nudna! Zaczynamy!
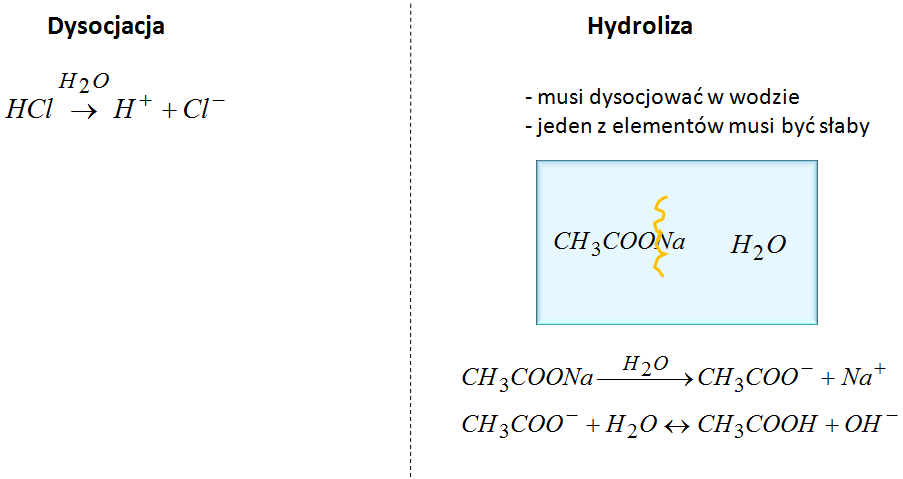
Hydroliza kontra dysocjacja – jak je odróżnić?
Często hydroliza bywa mylona z dysocjacją, a to tak, jakby pomylić lodówkę z mikrofalówką – niby kuchenne sprzęty, ale działają zupełnie inaczej. Jak więc nie wpaść w studencki zaułek? Prosta sprawa!
Dysocjacja – woda robi za widza
W dysocjacji woda tylko stoi z boku i kibicuje, patrząc, jak inne substancje rozpadają się na jony. W reakcji tej woda nie bierze czynnego udziału, dlatego też piszemy ją nad strzałką, jakby pokazywała: „Hej, to nie moja sprawa!”.
Hydroliza – woda wchodzi do gry
W hydrolizie woda wcale nie chce być biernym obserwatorem – wchodzi w reakcję i mówi: „Dobra, teraz moja kolej!”. Aby doszło do tego procesu, sól musi najpierw się rozpaść (dysocjować), a jeden z jej składników musi pochodzić od słabego elektrolitu. Dla przykładu: octan sodu jest tu dobrym kandydatem. Można go porównać do tego gościa, który zawsze mówi, że ma słabe mięśnie, ale kiedy przychodzi co do czego, to jednak daje radę.
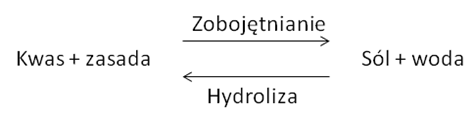
Przynajmniej formalnie proces hydrolizy jest procesem odwrotnym do reakcji zobojętniania.
Hydroliza a pH – kwas, zasada, a może neutralnie?
Skutkiem hydrolizy jest zmiana pH roztworu. I teraz ciekawa zabawa: w zależności od tego, z jaką solą mamy do czynienia, otrzymujemy różne odczyny pH.
- Sole z mocnych zasad i słabych kwasów – odczyn zasadowy .
- Sole z mocnych kwasów i słabych zasad – odczyn kwaśny
- Sole z słabych kwasów i słabych zasad – odczyn neutralny
- Sole z mocnych kwasów i mocnych zasad – no cóż, te sole są neutralne i nie ulegają hydrolizie (nudziarze!).
Aby dokładnie określić pH, musisz sprawdzić stałe dysocjacji. W chemii nie ma miejsca na domysły – trzeba to dokładnie obliczyć!
Przykłady hydrolizy – kto z kim się rozgrywa?
Pora na konkrety! Poniżej trzy warianty, w których hydroliza szaleje na całego. W innych przypadkach nic się nie dzieje, bo do tanga trzeba dwojga, a tu przynajmniej jeden składnik musi być słaby!
Mocna zasada i słaby kwas – przykład z octanem sodu
a. Dysocjacja: CH₃COONa ---> Na⁺ + CH₃COO⁻
b. Hydroliza: CH₃COO⁻ + H₂O --->CH₃COOH + OH⁻
To co zostaje z wody to OH-
Mocny kwas i słaba zasada – przykład z chlorkiem żelaza (III)
a. Dysocjacja: FeCl₃ ---> Fe³⁺ + 3Cl⁻
b. Hydroliza: Fe³⁺ + 3H₂O ---> Fe(OH)₃ + 3H⁺
Słaby kwas i słaba zasada – przykład z mrówczanem amonu
a. Dysocjacja: HCOONH₄ ---> NH₄⁺ + HCOO⁻
b. Hydroliza NH₄⁺ + H₂O ---> NH₃·H₂O + H⁺
c. Hydroliza HCOO⁻ + H₂O ---> HCOOH + OH⁻
Ciekawostka: Jak zobaczyć hydrolizę gołym okiem?
To proste! Gdy masz do czynienia z octanem sodu lub chlorkiem żelaza, wystarczy popatrzeć na reakcję i zobaczyć, jak zmienia się odczyn pH. Jeśli roztwór staje się zasadowy lub kwaśny, to znaczy, że właśnie patrzysz na hydrolizę w akcji! W przypadku soli pochodzących od mocnych kwasów i zasad (np. NaCl) – nie licz na żadną magię. Hydroliza tam nie zachodzi i tyle!

Na zakończenie – hydroliza to całkiem zabawny temat!
Hydroliza brzmi jak poważna sprawa, ale kiedy przyjrzymy się jej bliżej, okazuje się, że to chemiczny spektakl, w którym woda nie chce być tylko biernym obserwatorem. Pamiętaj, jeśli jeden z elementów związku jest „słaby” – to znaczy, że hydroliza może wkroczyć do akcji!
Jeśli szukasz kompleksowego kursu, w którym w jednym miejscu będziesz miał omówioną teorię i obliczone sporo zadań to zachęcam do odwiedzenia linka: https://fizyka-kursy.pl/kurs/hydroliza




