Analiza termiczna — co to jest i jak ją zrozumieć?
Cześć! Dziś dowiemy się, czym jest analiza termiczna i jak dzięki niej tworzy się wykresy, które wyglądają jak techniczne dzieła sztuki. Będziemy też mówić o tym, po co w ogóle się tym zajmować — no bo kto by nie chciał wiedzieć, dlaczego cyna i ołów zachowują się jak dwa różne typy na imprezie? To co, zaczynamy?
Wykresy — czyli co się dzieje, gdy cyna poznaje ołów?
Kiedy mieszamy cynę z ołowiem (albo inne składniki, ale cyna i ołów brzmią jak dobrzy kumple), wykresy pokazują, jak zmieniają się ich temperatury topnienia i krzepnięcia. Ale uwaga! Niektóre ciała stałe po zakrzepnięciu zmieniają strukturę.
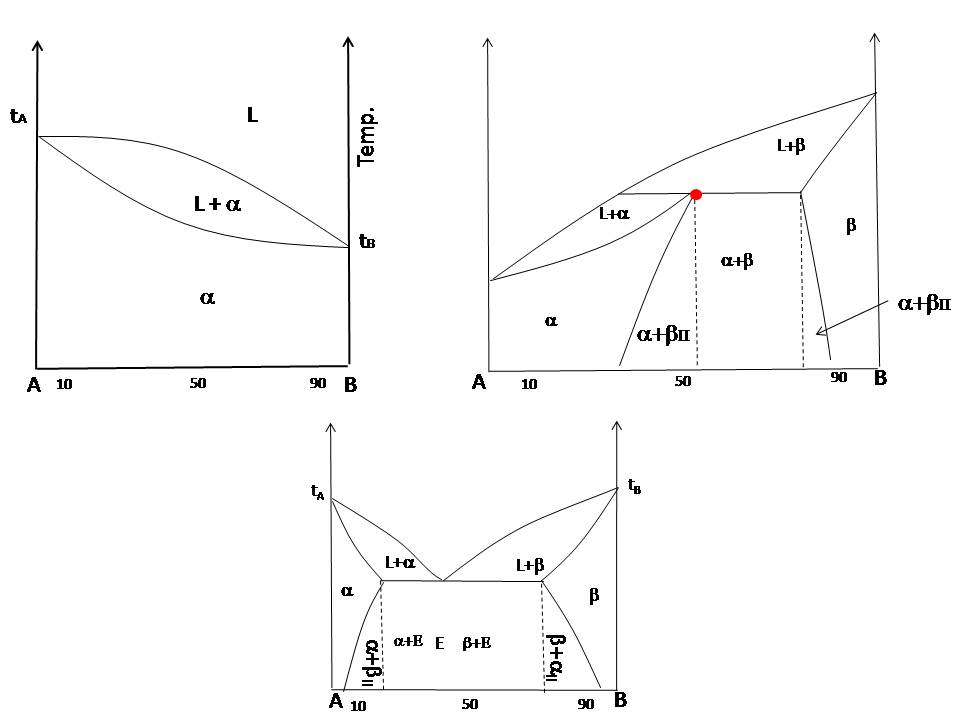
Wykresy jak poniżej pokazują w jaki sposób zmienia się temperatura topnienia i krzepnięcia zależności od składu w układzie, w którym mieszamy ze sobą dwa składniki np. cynę i ołów. Oprócz tego na tego typu wykresach widać, że niektóre ciała już po zakrzepnięciu nadal zmieniają swoją strukturę tworząc różnego rodzaju fazy ciała stałego. Po co tworzy się tego typu wykresy? Na ich podstawie można wnioskować właściwości mechaniczne danego stopu, czy np. układ będzie charakteryzował się dużą twardością, a może innymi właściwościami mechanicznymi. To wszystko można zaobserwować na wykresach!
Jak otrzymuje się takie wykresy? Magiczny proces w kilku krokach
Żeby stworzyć taki wykres, musisz zabawić się w małego chemika i przygotować kilka próbek. Spokojnie, nie musisz się martwić o ilość zadań domowych, pokażę Ci tylko uproszczoną wersję:
1 próbka 100% składnika A
2 próbka 50% składnika A + 50% składnika B
3 próbka 100% składnika B
Zwykle tych próbek byłoby znacznie więcej uwzględniając również inne proporcje jednego składnika do drugiego. Na potrzeby wytłumaczenia analizy termicznej taka ilość próbek nam wystarczy. Następnie każdą z próbek należy rozgrzać tak, żeby mieszaniny składników stopiły się tworząc jednolite roztwory. W omówieniu tego zagadnienia posłużę się diagramem fazowym charakteryzującym się pełną mieszalnością w fazie ciekłej i stałej. W pierwszej próbce przeanalizujmy najpierw układ gdy mamy 100% składnika A.
Zgodnie z wytycznymi pierwszą próbkę podgrzewamy aż układ się stopi, da jednolity roztwór. Następnie układ zaczynamy chłodzić a wszelkie zmiany nanosimy na wykresie temperatury w funkcji składu.
Krystalizacja — czyli dlaczego wykres nagle przestaje się ruszać?
W pewnym momencie na wykresie zauważysz, że linia przestaje spadać i robi sobie przerwę. Co to za numer? Otóż, to proces krystalizacji! Proces krystalizacji jest procesem egzotermicznym, czyli z wydzieleniem ciepła, dlatego na wykresie T=f(czas) w miejscu, w którym nastąpiła krystalizacja, spadek temperatury się zatrzymał. Wykres na chwilę mówi: „Ej, poczekajcie, tu się coś dzieje!” i robi sobie pauzę. Po zakończeniu krystalizacji temperatura znowu leci w dół jak nastrój po poniedziałkowym poranku.
Na wykresie temperatury w funkcji stężenia procentowego w miejscu gdzie mamy 100% składnika A w temperaturze, w której nastąpiła krystalizacja nanosimy czerwoną kropkę. Żeby zbyt bardzo Cię nie zanudzać dokładnie tymi samymi analizami, różniącymi się tylko składem początkowym, to zrobimy teraz mały skok i przeanalizujemy sytuację gdy w układzie mamy 50% składnika A i 50% składnika B.
Przypadek mieszany: 50% A i 50% B — dwa razy więcej zabawy!
Kiedy mamy mieszankę pół na pół składników, robi się jeszcze ciekawiej. Dlaczego? Bo na wykresie są aż dwa załamania. To tak jakby układ mówił: „Najpierw jeden kryształ, potem drugi, a potem możecie wracać do swoich zajęć”. Każde załamanie to jak scena w filmie akcji, gdzie kryształ zaczyna pojawiać się na powierzchni, a temperatura staje w miejscu. Dopiero jak wszystko zakrzepnie, wykres znowu zaczyna spadać jak pociąg na rollercoasterze.
100% składnika B — powtórka z rozrywki
Ostatnia próbka to klasyka — 100% składnika B. Znowu krystalizacja, znowu załamanie na wykresie. Czerwona kropka na wykresie, to znak, że proces się dzieje. Trochę jak checkpoint w grze, prawda?Tych pomiarów oczywiście powinno być więcej nie mniej jednak na potrzeby analizy tego problemu myślę, że to wystarczy.
Łączenie kropek — czyli gotowy diagram fazowy!
Kiedy masz już wszystkie kropki na swoim miejscu, pozostaje je tylko połączyć, a voila! Masz gotowy diagram fazowy, który możesz pokazać znajomym. Nie obiecuję, że będzie to najlepszy temat do rozmowy na imprezie, ale hej — przynajmniej Ty wiesz, co się dzieje w środku metalu!
Więcej o takich ciekawostkach dowiesz się w moim kursie o równowagach fazowych. Omówiłem tam mnóstwo wykresów i rozwiązałem różne zadania, więc zapraszam!