Jak Obliczyć Stopień Dysocjacji Kwasu Octowego? Spokojnie, To Tylko Brzmi Strasznie!
Chemia potrafi czasami wydawać się trudna, ale spokojnie, dzisiaj obliczymy stopień dysocjacji kwasu octowego. Zrobimy to bez nerwów, z humorem i uśmiechem, a na koniec nawet zaproszę Cię na herbatkę z kwasem octowym! (spoiler: nie próbuj tego w domu).
Treść zadania: Oblicz stopień dysocjacji kwasu octowego o stężeniu molowym 1,7 mol/dm3 . I=1A.
Kwas Octowy i Dysocjacja – Zacznijmy Od Rozpiski!
Zawsze warto zacząć od podstaw, więc najpierw napiszmy równanie reakcji dysocjacji kwasu octowego. Nie bój się, to tylko kilka symboli! Oto nasza gwiazda dnia:
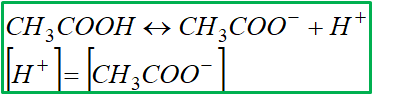
Jak widać, kwas octowy rozdziela się na jon wodorowy (H⁺) i anion octanowy (CH₃COO⁻). Takie to proste!
Czas na Obliczenia, Ale Bez Paniki!
Wiemy już, że mamy obliczyć stopień dysocjacji, prawda? Warto również napisać równanie na stopień dysocjacji.
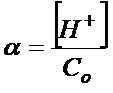
Stopień dysocjacji nie zawsze musi być podany w procentach. Jak nie pomnożymy tego razy 100% to otrzymamy wartość bezwymiarową, bezprocentową.
No dobrze! Mamy obliczyć alfę (stopień dysocjacji). Co znamy z treści zadania na ten moment a co jeszcze musimy obliczyć?
Z treści zadania znamy stężenie kwasu octowego: 1,7 mol/dm³ czyli Co znamy. To całkiem mocna dawka, prawie jak mocna kawa przed egzaminem z chemii! Ale niestety nie znamy stężenia jonów wodorowych [H⁺], co jest kluczowe, by obliczyć stopień dysocjacji. Bez stężenia jonów wodorowych oczywiście nie jesteśmy w stanie obliczyć stopnia dysocjacji. Musimy to jakoś obliczyć! Tylko pytanie jak?
Spokojnie, To Tylko Słaby Kwas!
Zanim przejdziemy do obliczeń to najpierw może przyjrzyjmy się jeszcze raz reakcji. No więc tak, kwas octowy jest słabym kwasem. To jest bardzo ważne spostrzeżenie! Skoro to jest słaby kwas to znaczy, że musi on słabo dysocjować. A jeśli tak to w układzie musi się wytworzyć jakaś równowaga między tym co już zdysocjowało, a tym co nie zdysocjowało.
Równanie Stałej Dysocjacji – Jak To Ogarnąć?
Wykorzystajmy to spostrzeżenie i napiszmy stałą dysocjacji dla powyższej reakcji:
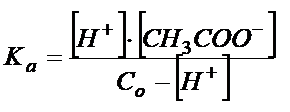
To na co chciałbym żebyś zwrócił swoją uwagę w stałej dysocjacji to to, że w mianowniku musi być to co nie zdysocjowało! Właśnie dlatego od stężenia początkowego Co odjąłem to co zdysocjowało, czyli [H+]
Stała Ka wygląda zawsze tak samo, to znaczy w liczniku jest iloczyn stężeń produktów, dlatego mam tutaj stężenie [H+] oraz stężenie anionów octanowych [CH3COO-], a w mianowniku jest stężenie tego co nie zdysocjowało, dlatego od całkowitego stężenia kwasu Co odjąłem [H+].
Kwas octowy jest słabym kwasem. To znaczy, że słabo dysocjuje. Z tego wynika, że stężenie tego co powstało w wyniku dysocjacji, czyli stężenie [H+] jest dużo mniejsze od stężenia kwasu. Zapiszmy to w sposób matematyczny:
Proste Założenie: Co >> [H⁺]
Co>>[H+]
Co z tego założenia wynika? Jeśli [H+] jest bardzo małe to w zasadzie nie popełniając dużego błędu można to stężenie wyrzucić z mianownika.
Jeszcze jedna ważna sprawa, spójrz jeszcze raz na reakcję dysocjacji. Z reakcji widać, że otrzymamy taką samą liczbę moli jonów wodorowych i octanowych. Skoro ich ilości są takie same to również ich stężenia muszą być takie same.
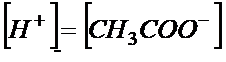
Mając już ten komplet informacji możemy teraz uprościć równanie na stałą dysocjacji.
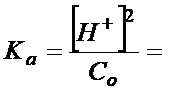
Drugie równanie jakie napisałem w tym artykule (stopień dysocjacji) można teraz przekształcić i wyciągnąć z niego [H+] oraz wstawić do powyższego wzoru:
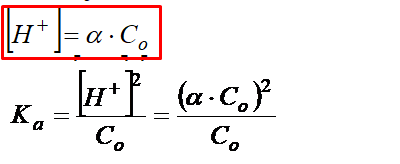
Obliczamy Alfę – Stopień Dysocjacji!
Zobacz, w powyższym równaniu pojawiła się już a, czyli stopień dysocjacji, który przecież mamy obliczyć! Przekształćmy to i dokończmy obliczenia.
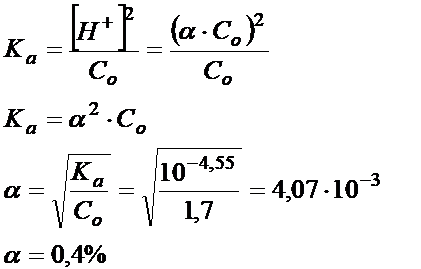
Zakłada się, że gdy stopień dysocjacji jest mniejszy od 1% to założenie, które dokonaliśmy odnośnie mianownika rzeczywiście miało niewielki wpływ na wynik końcowy. Gdyby stopień dysocjacji był większy od 1% to wówczas trzeba by powtórzyć obliczenia i nie dokonywać założeń odnośnie mianownika.
Podsumowanie – Dysocjacja Kwasu Octowego w Pigułce (Nie Dosłownie)
Kwas octowy to słaby zawodnik na arenie chemicznej, ale na szczęście my wiemy, jak poradzić sobie z jego dysocjacją. Obliczyliśmy stopień dysocjacji, zakładając, że [H⁺] jest małe, a równowaga chemiczna to nasze narzędzie. Czy to wszystko było łatwe? Może nie, ale na pewno było śmieszniej niż się spodziewałeś!
Jeśli nadal masz wątpliwości, obejrzyj mój film na YouTube. A potem zapraszam do mojego kursu, gdzie dowiesz się jeszcze więcej. Chemia nie musi być nudna, a ja to udowodnię!
YouTube: https://www.youtube.com/watch?v=d-zZ85A2tr0
Kursu z chemii nieorganicznej:
https://fizyka-kursy.pl/kurs/chemia-nieorganiczna-1a




