Zadanie - izobara van’t Hoffa
Treść zadania: Na kolokwium otrzymałeś następujące polecenie: Wzrost temperatury z 298K do 308K powoduje 2-krotny wzrost stałej równowagi ciśnieniowej. Na tej podstawie oblicz ile wynosi standardowa molowa entalpia reakcji.
Zanim przejdziemy do obliczenia tego zadania zachęcam do odwiedzenia artykułu odnośnie izobary van’t Hoffa. Omówiłem nim niezbędna teorię potrzebną do zrozumienia tej tematyki: https://fizyka-kursy.pl/blog/izobara-van-t-hoffa
Zacznijmy od tego jaki wzór łączy ze sobą informacje odnośnie temperatury, stałej równowagi oraz entalpię reakcji? To jest oczywiście izobara van’t Hoffa
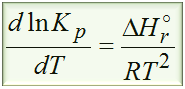
Wzór na izobarę van’t Hoffa jak widzisz to równanie różniczkowe, czyli równanie z pochodnymi. Tego typu równanie różniczkowe można rozwiązać w bardzo łatwy sposób. Wystarczy tylko rozdzielić zmienne, czyli dlnKp zostawić na jednej stronie równania, natomiast dT przerzucić na prawo, a następnie scałkować każdą pochodną (metoda całkowa).
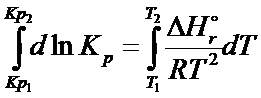
Lewą stronę scałkujemy i wstawimy granice całkowania natomiast z prawej strony najpierw wartości stałe wyrzucimy przed całkę.
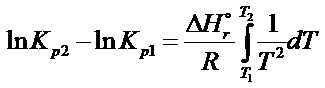
Poniżej pokazuję jak można rozwiązać całkę po prawej stronie:
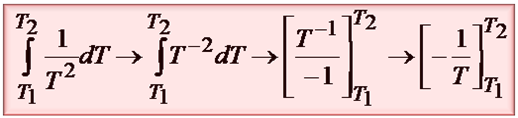
Z własności logarytmów wiemy, że odejmowanie logarytmów o tej samej podstawie można zastąpić przez ich podzielenie:
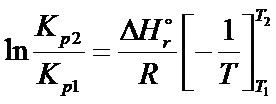
Po wprowadzeniu granic całkowania i po przekształceniu otrzymujemy entalpię reakcji:
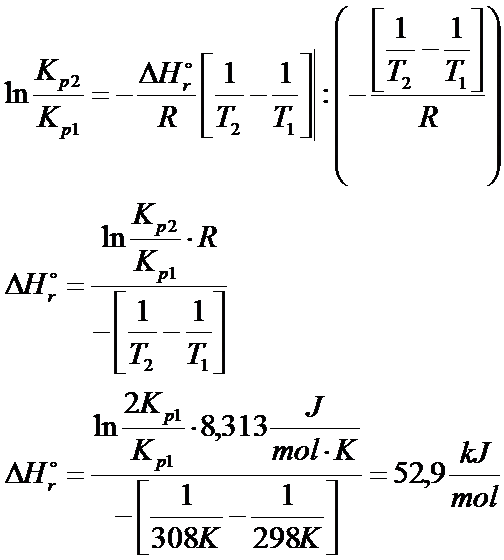
Sporo zadań z tej tematyki obliczyłem w kursie "Potencjał chemiczny, entalpia swobodna"
https://fizyka-kursy.pl/kurs/potencjal-chemiczny-entalpia-swobodna





