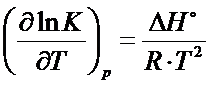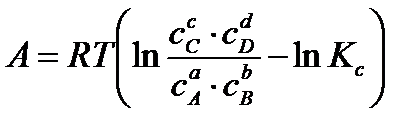Izobara van’t Hoffa
Jacobus van’t Hoff zaproponował kilka równań, które łączyły ze sobą stałą równowagi reakcji, temperaturę i efekt energetyczny reakcji. Tymi równaniami są izobara van’t Hoffa
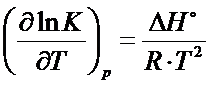
i izochora van’t Hoffa.
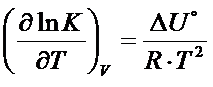
Opracował on jeszcze izotermę van’t Hoffa
Jeśli chodzi o izobarę van’t Hoffa i izochorę to dużo większe znaczenie dla chemików ma ta pierwsza. Być może zastanawiasz się dlaczego? A dlatego, że większość doświadczeń jakie się przeprowadza są w stałym ciśnieniu. Obrazowo mówiąc układy o stałym ciśnieniu to najczęściej otwarte reaktory, w których panuje ciśnienie atmosferyczne, które podczas doświadczenia ma stałą wartość (a więc się nie zmienia). Zdecydowanie rzadziej stosuje się układy zamknięte, w których mamy ściśle określoną objętość. Ciśnienie w takich układach zmienia się wraz ze zmianą temperatury (temperatura rośnie--> ciśnienie rośnie, temperatura maleje --> ciśnienie maleje).
Za pomocą Izobara van’t Hoffa można określić wpływ temperatury na stałą równowagi reakcji przy stałym ciśnieniu. Poniżej wyprowadzenie wzoru na izobarę van’t Hoffa:
- Najpierw trzeba zacząć, że izobara porównuje stałe równowagi Kp1 i Kp2 z dwóch różnych temperatur T1 i T2. Do tej pory zawsze jak chcieliśmy porównać jakieś 2 stany to wystarczyło od stanu drugiego odjąć stan pierwszy. Tym razem też tak zrobimy. Z tego powodu najpierw wyprowadzimy równanie dla temperatury T1 , a potem takie samo dla temperatury T2 poczym jedno równanie odejmiemy od drugiego.
Jednym z najważniejszych pojęć w chemii to entalpia swobodna. Gdy układ znajduje się w równowadze to można obliczyć standardową entalpię swobodną reakcji na 2 sposoby:
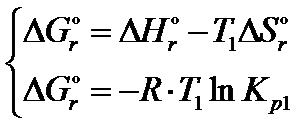
Po przyrównaniu obu wzorów do siebie otrzymujemy zależność jak poniżej
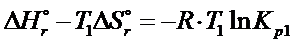
To równanie można tak przekształcić, żeby logarytm ze stałej ciśnieniowej był po lewej stronie równania, a cała reszta po prawej.
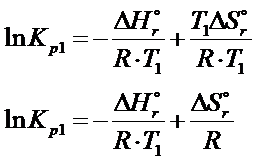
Dokładnie takie same równanie można wyprowadzić do temperatury T2
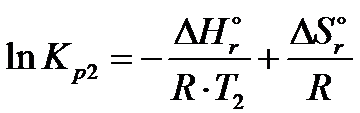
Następnie tak jak już napisałem wcześniej należy odjąć od siebie logarytmy ze stałych ciśnieniowych Kp2 i Kp1. Po kilku przekształceniach ostatecznie dojedziemy do izobary van’t Hoffa, która przedstawia zależność między stałymi ciśnieniowymi, temperaturą a standardową entalpią danej reakcji
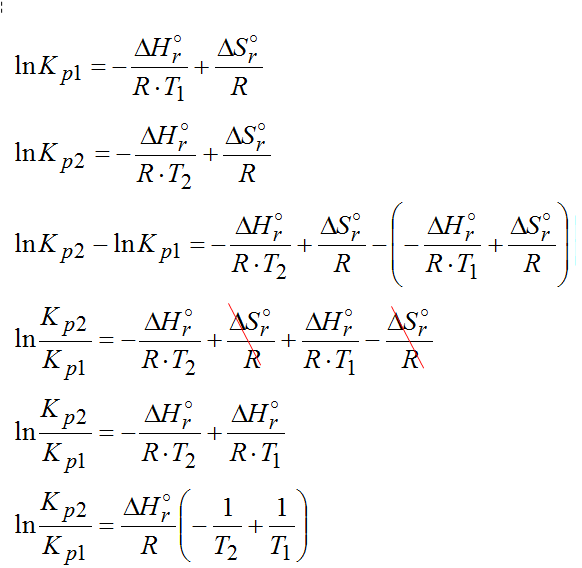
Ten wzór można też przedstawić w sposób różniczkowy. Wówczas wygląda on tak: