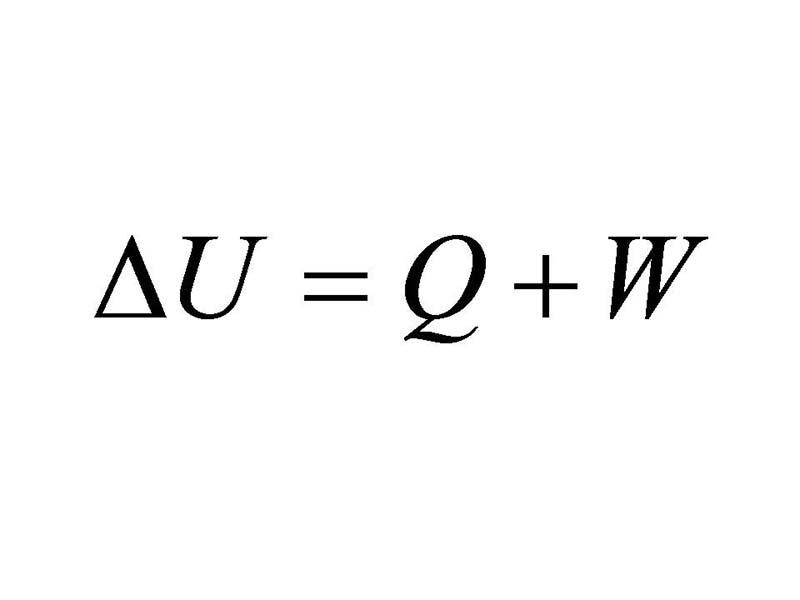I zasada termodynamiki
I zasadę termodynamiki można przedstawić za pomocą następującego wzoru:
ΔU=Q+W
Powyższy wzór mówi o tym, że jeśli chcemy zmienić energie wewnętrzną układu to musimy dostarczyć do układu ciepło albo wykonać pracę nad układem. A co to dokładnie oznacza?
Żebyś dobrze zrozumiał ten wzór to najlepiej posłużyć się przykładem. W tym celu rozpatrzmy gaz zamknięty w cylindrze z ruchomym tłokiem.
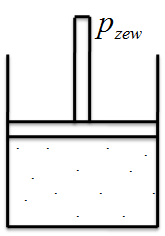
I zasada termodynamiki odnosi się do energii wewnętrznej układu. Na energie wewnętrzną układu składają się wszelkiego rodzaju ruchy cząsteczek (drgania, oscylacja, rotacja). Żeby zwiększyć energię wewnętrzną, czyli zwiększyć ruchy cząstek to najłatwiej po prostu dostarczyć do układu ciepło Q (wraz z ciepłem ruch cząsteczek się zwiększa a tym samym ich energia wewnętrzna również).
Ale czy to jest jedyny sposób na zwiększenie energii wewnętrznej? A no nie, również możemy np. wykonać pracę nad układem czyli przycisnąć tłok. W ten sposób również zwiększymy energię wewnętrzną układu.
We wzorze na energię wewnętrzną praca może mieć znak dodatni lub ujemny. Warto zapamiętać że:
- jeśli to my wykonujemy pracę nad układem, czyli ściskamy gaz za pomocą tłoku to wówczas praca jest dodatnia, dlatego że energia wewnętrzna takiego układu rośnie.
-jeśli układ wykonuje pracę to tym samym jego energia wewnętrzna maleje.
ΔU=Q+W
Tak więc jak widzisz energię wewnętrzną układu można zmienić na 2 sposoby (dostarczyć ciepło albo wykonać pracę) i to spostrzeżenie nazwano I zasadą termodynamiki.
U mnie na stronie znajdziesz sporo informacji na temat I zasady termodynamiki w kursie z chemii fizycznej 1b
https://fizyka-kursy.pl/kurs/chemia-fizyczna-1b
oraz w kursie z termodynamiki 1a
https://fizyka-kursy.pl/kurs/termodynamika-1b
Odsyłam również do artykułu na zerową zasadę termodynamiki https://fizyka-kursy.pl/blog/zerowa-zasada-termodynamiki