Hydroliza
Hydroliza - to pojęcie w chemii, które jest dosyć popularne. Godzi ono wiecznie skłóconych chemików organicznych i nieorganicznych, dlatego że jedni i drudzy znaleźli do niej zastopowanie. W chemii nieorganicznej pojęcie jest wykorzystywane w wodnych roztworach soli.
Akurat w tym artykule zajmiemy się wodnymi roztworami.
Od razu zacznijmy od zaułku, w którym często wpadają studenci, a mianowicie hydroliza często jest mylona z dysocjacją. A jak odróżnić jedno od drugiego?
Zacznijmy od dysocjacji. W reakcji dysocjacji woda nie wchodzi w reakcję z substancją. Ona tylko powoduje rozpad na jony, dlatego w dysocjacji woda jest pisana nad strzałką.
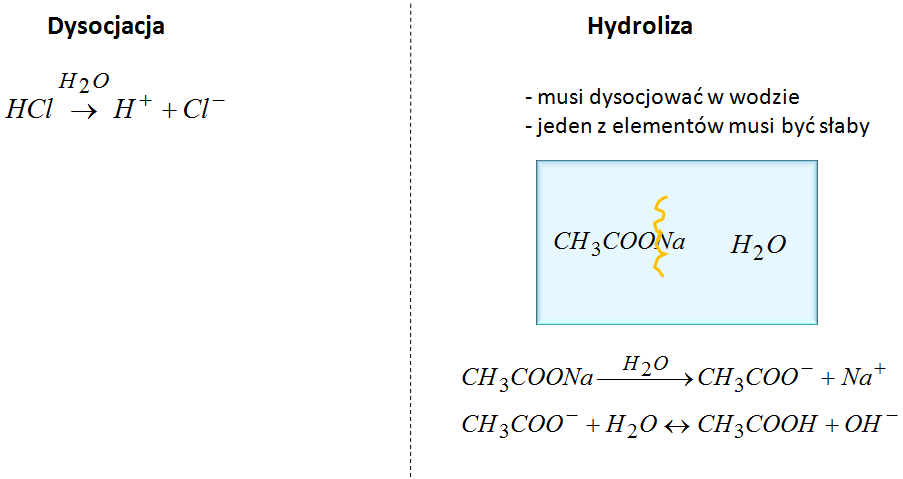
Natomiast w przypadku hydrolizy, woda wchodzi w reakcję. Aby mogła zajść hydroliza to sól musi dysocjować w wodzie, a jeden z elementów soli musi pochodzić od słabego elektrolitu. Przykładem takiej soli może być octan sodu.
Przynajmniej formalnie proces hydrolizy jest procesem odwrotnym do reakcji zobojętniania.
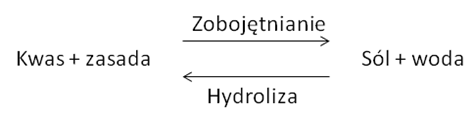
Na skutek hydrolizy zmienia się pH roztworu. W zależności z jaką solą mamy do czynienia mamy następujące odczyny:
- Sole pochodzące od słabych kwasów i mocnych zasad mają odczyn zasadowy
- Sole pochodzące od słabych zasad i mocnych kwasów mają odczyn kwaśny
- Sole pochodzące od słabych kwasów i zasad mają odczyn zbliżony do obojętnego
- Sole pochodzące od mocnych kwasów i zasad nie ulęgają hydrolizie, ich odczyn jest obojętny
Żeby ustalić pH roztworu soli pochodzącej od słabych kwasów i zasad należy przeanalizować stałe dysocjacji.
Octan sodu jest bardzo dobrze rozpuszczalny w wodzie a oprócz tego jon octanowy pochodzi od słabego kwasu. Pierwsze co trzeba pokazać w przypadku hydrolizy to, to że dany związek dysocjuje, czyli rozpada się na jony. I następnie bierzemy jon, który pochodzi od słabego elektrolitu i pokazujemy, że reaguje on z wodą w wyniku czego otrzymujemy słaby kwas. Tak więc z wody pobraliśmy wodór, dzięki czemu otrzymaliśmy kwas octowy. To co zostaje z wody to OH-
Różnicę między dysocjacją a hydrolizą widać gołym okiem.
Hydrolizie nie ulegają związki, które pochodzą od mocnego kwasu i zasady. Np. NaCl. Warunkiem koniecznym zajścia hydrolizy jest to, żeby przynajmniej jeden z elementów pochodził od słabego elektrolitu, taką sytuację mamy w dwóch przykładowych związkach wymienionych obok, np. CH3COONa, NH4Cl itd. Słabe jest to co nie dysocjuje w 100%. Poniżej przykład związków słabych i mocnych:

Tak jak już pisałem przynajmniej jeden z elementów musi być słaby. Poniżej 3 warianty, w których zachodzi hydroliza. W innych przypadkach hydroliza nie zachodzi.
Hydrolizują następujące związki:
- a) mocna zasada i słaby kwas
- b) słabe zasady i mocne kwasy
- c) słabe zasady i słabe kwasy
Poniżej przykłady do każdego z przypadków
Ad a)
Dysocjacja: CH3COONa--->Na++CH3COO-
Hydroliza: CH3COO-+H2O--->CH3COOH+OH-
Ad b)
Dysocjacja: FeCl3--->Fe3++3Cl-
Hydroliza: Fe3++3H2O--->Fe(OH)3+3H+
Ad c)
Dysocjacja: HCOONH4--->NH4++HCOO-
Hydroliza: NH4++H2O--->NH3*H2O+H+
Hydroliza: HCOO-+H2O---> HCOOH+OH-
Jeśli szukasz kompleksowego kursu, w którym w jednym miejscu będziesz miał omówioną teorię i obliczone sporo zadań to zachęcam do odwiedzenia linka: https://fizyka-kursy.pl/kurs/hydroliza




