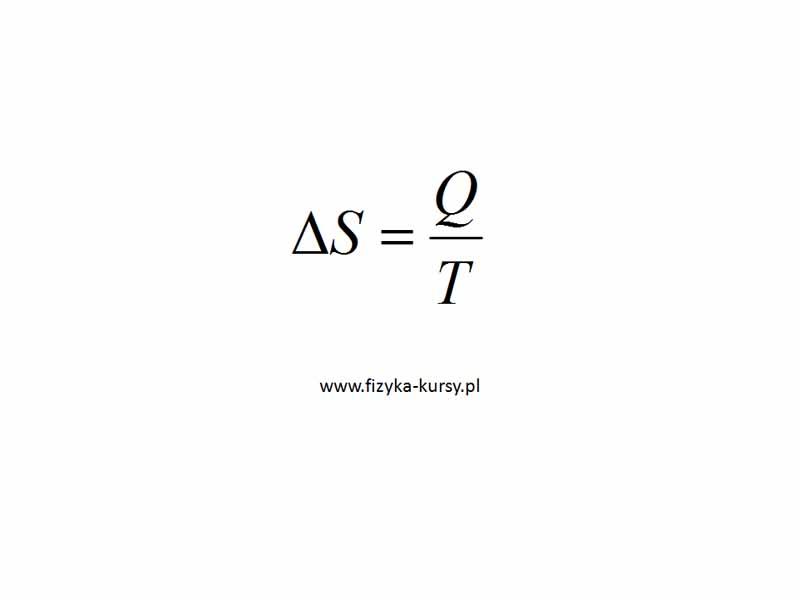Entropia
Zanim przejdę do opisu matematycznego tego zjawiska chciałbym żebyś najpierw zrozumiał sens i zobaczył, że entropia autentycznie cały czas nas otacza. A skoro coś jest bardzo powszechne to łatwiej to zrozumieć. Trzeba tylko wiedzieć na co zwracać uwagę.
Żeby to udowodnić posłużę się przykładem. Jeśli na przykład jedziesz na wakacje i zostawiasz dom bez opieki to po powrocie mieszkanie wymaga sprzątania, mimo iż nikt w tym czasie nie mieszkał. Kurz i pajęczyny są absolutnie wszędzie. Entropia to wszystko tłumaczy! Za taki stan rzeczy odpowiedzialny jest naturalny układ, który zawsze dąży do nieporządku, czyli do zwiększenia entropii, a ten kurz i nieporządek tego dowodzi. O tym właśnie mówi II zasada termodynamiki.
Zgodnie z definicją entropia jest funkcją stanu będącą miarą nieuporządkowania i oznaczamy ją ΔS. Jeśli entropia, czyli nieuporządkowanie układu rośnie ΔS>0 to znaczy, że mamy do czynienia z procesem nieodwracalnym, czyli z takimi, którego nie da się odwrócić.
Czy podać Ci jakiś przykład procesu nieodwracalnego? Proszę bardzo :) Prostym przykładem procesu nieodwracalnego jest np. przepływ ciepła. Ciepło przepływa z ciała o wyższej temperaturze do ciała o niższej temperaturze, nigdy na odwrót! Nie da się odwrócić tego procesu, a skoro tak, to przepływ ciepła jest dobrym przykładem procesu nieodwracalnego.
A co w przypadku procesów odwracalnych? Zmiana entropii takiego układu jest równa zero ΔS=0. Procesem odwracalnym jest np. sprężyna. Po prostu zaistniały nieporządek (naciągnięcie sprężyny) daje się cofnąć. A skoro nieporządek idzie odwrócić to zmiana entropii (czyli zmiana nieporządku takiego układu) musi być równa zero, bo układ wraca do stanu początkowego.
Entropię układu można zmieniać na 2 sposoby. Pierwszy z nich to poprzez produkcję entropii. Z produkcją entropii mamy do czynienia gdy w układzie np. zachodzi jakaś reakcja chemiczna, w wyniku czego wydziela się ciepło. Wraz z ciepłem rosną drgania cząsteczek, a tym samym nieporządek w układzie rośnie. Drugim sposobem zmiany entropii jest tak zwany transport entropii tzn. dostarczanie ciała do układu z zewnątrz. W taki sposób można zmieniać entropię układu.

Teraz trzeba jeszcze powiedzieć o cechach charakterystycznych procesu odwracalnego i nieodwracalnego.
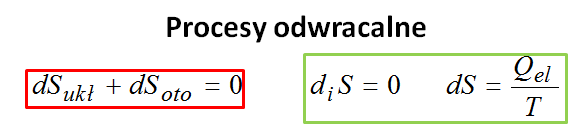
W procesie odwracalnym gdy się zsumuje zmianę entropii układu i otoczenia to jest ona równa zero. Dodatkowo w takim układzie produkcja entropii jest równa zero a zmianę entropii można dokonać tylko na skutek transportu entropii.
Jeśli natomiast chodzi o procesy samorzutne i nieodwracalne to zmiana entropii układu i otoczenia zawsze jest większa od zera. Tak więc jeśli Ci wyjdzie, że suma zmian entropii jest większa od zera to znaczy, że masz do czynienia z procesami samorzutnymi i nieodwracalnymi.

Zmianę entropii można obliczyć dzieląc ciepło przez temperaturę.
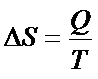
Jak widzisz w powyższym wzorze, na transport entropii, jest ciepło. Jak można obliczyć ciepło? Ciepło możesz znaleźć we wzorze na zmianę entalpii oraz w pierwszej zasadzie termodynamiki (zmiana energii wewnętrznej). Który z tych wzorów będziesz najczęściej wykorzystywał do obliczenia ciepła? Zdecydowanie najczęściej będziesz korzystał ze wzoru na zmianę entalpii. Dlaczego? A dlatego, że większość procesów odbywa się w stałym ciśnieniu, a jak mamy do czynienia ze stałym ciśnieniem to najlepiej skorzystać z entalpii, bo wówczas wzór nam się upraszcza (znika człon Vdp – patrz poniżej) i wychodzi, że ciepło jest równe zmianie entalpii.
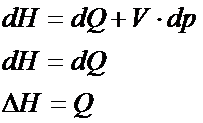
Do tej pory zmianę entalpii czy energii wewnętrznej można było obliczyć korzystając z różniczki zupełnej. W przypadku entropii jest tak samo. Również możemy skorzystać z różniczki zupełnej! Żeby więc napisać różniczkę zupełną dla entropii trzeba wiedzieć jakie parametry wpływają na nieporządek układu. Na pewno na nieporządek wpływa zmiana temperatury, ciśnienia i objętości. W związku z tym różniczkę zupełną dla entropii możemy napisać w 2 wersjach jak poniżej:

Zdecydowanie najczęściej do obliczenia zmiany entropii będziesz korzystał z tych 2 wzorów znajdujących się powyżej w czerwonej ramce.
Tyle mówi teoria jeśli chodzi o entropię. Żeby jednak dobrze to zrozumieć i umieć wykorzystać w praktyce musisz teraz policzyć trochę zadań z tej tematyki.
Tego typu zadania znajdziesz u mnie w kursie z chemii fizycznej 1b. Poniżej przesyłam link bezpośrednio do kursu. https://fizyka-kursy.pl/kurs/chemia-fizyczna-1b
Pozdrawiam i życzę powodzenia na kolokwiach :)